Nature Communications 12 , Número do artigo: 2349 ( 2021 )
Abstrato
Investimentos substanciais em pesquisa do COVID-19 foram alocados para ensaios clínicos randomizados (RCTs) sobre hidroxicloroquina / cloroquina, que atualmente enfrentam desafios de recrutamento ou descontinuação precoce. Nosso objetivo é estimar os efeitos da hidroxicloroquina e da cloroquina na sobrevivência em COVID-19 a partir de todas as evidências de RCT disponíveis atualmente, publicadas e não publicadas. Apresentamos uma meta-análise rápida de RCTs em andamento, concluídos ou descontinuados em tratamento com hidroxicloroquina ou cloroquina para qualquer paciente COVID-19 (protocolo: https://osf.io/QESV4/) Nós identificamos sistematicamente RCTs não publicados (ClinicalTrials.gov, WHO International Clinical Trials Registry Platform, Cochrane COVID-registro até 11 de junho de 2020) e RCTs publicados (PubMed, medRxiv e bioRxiv até 16 de outubro de 2020). A mortalidade por todas as causas foi extraída (publicações / pré-impressões) ou solicitada aos investigadores e combinada em meta-análises de efeitos aleatórios, calculando odds ratios (OR) com intervalos de confiança de 95% (IC), separadamente para hidroxicloroquina e cloroquina. As análises de subgrupos pré-especificadas incluem configuração do paciente, confirmação diagnóstica, tipo de controle e status da publicação. Sessenta e três ensaios eram potencialmente elegíveis. Incluímos 14 estudos não publicados (1.308 pacientes) e 14 publicações / pré-impressões (9011 pacientes). Os resultados para hidroxicloroquina são dominados por RECUPERAÇÃO e SOLIDARIEDADE DA QUEM, dois ensaios altamente pragmáticos, que empregaram doses relativamente altas e incluíram 4716 e 1853 pacientes, respectivamente (67% do tamanho total da amostra). O OR combinado na mortalidade por todas as causas para hidroxicloroquina é 1,11 (IC 95%: 1,02, 1,20; I² = 0%; 26 ensaios; 10.012 pacientes) e para cloroquina 1,77 (IC 95%: 0,15, 21,13, I² = 0%; 4 ensaios; 307 pacientes). Não identificamos efeitos de subgrupo. Descobrimos que o tratamento com hidroxicloroquina está associado ao aumento da mortalidade em pacientes com COVID-19, e não há benefício da cloroquina. Os resultados têm generalização pouco clara para pacientes ambulatoriais, crianças, mulheres grávidas e pessoas com comorbidades. 1,02, 1,20; I² = 0%; 26 ensaios; 10.012 pacientes) e para cloroquina 1,77 (95% CI: 0,15, 21,13, I² = 0%; 4 ensaios; 307 pacientes). Não identificamos efeitos de subgrupo. Descobrimos que o tratamento com hidroxicloroquina está associado ao aumento da mortalidade em pacientes com COVID-19, e não há benefício da cloroquina. Os resultados têm generalização pouco clara para pacientes ambulatoriais, crianças, mulheres grávidas e pessoas com comorbidades. 1,02, 1,20; I² = 0%; 26 ensaios; 10.012 pacientes) e para cloroquina 1,77 (95% CI: 0,15, 21,13, I² = 0%; 4 ensaios; 307 pacientes). Não identificamos efeitos de subgrupo. Descobrimos que o tratamento com hidroxicloroquina está associado ao aumento da mortalidade em pacientes com COVID-19, e não há benefício da cloroquina. Os resultados têm generalização pouco clara para pacientes ambulatoriais, crianças, mulheres grávidas e pessoas com comorbidades.
Introdução
Doença por coronavírus 2019 (COVID-19) causada por coronavírus de síndrome respiratória aguda grave 2 (SARS-CoV-2) tem o potencial de progressão para insuficiência respiratória e morte 1 . Mais de 1.500.000 pessoas com COVID-19 em todo o mundo morreram até dezembro de 2020 2 , e as opções de tratamento são limitadas 3 . A pandemia COVID-19 causou uma busca sem precedentes por possíveis terapias, com quase 700 ensaios clínicos iniciados no primeiro trimestre de 2020 - e um em cada cinco desses ensaios tem como alvo a hidroxicloroquina (HCQ) ou cloroquina (CQ) 4 . Esta atenção notável foi principalmente devido aos dados in vitro 5 , capacidades imunomoduladoras 6, e a formulação oral e perfis de segurança bem documentados.
Em março de 2020, a Food and Drug Administration (FDA) dos EUA emitiu uma Autorização de Uso de Emergência do HCQ 7 e o número de prescrições e uso fora dos estudos clínicos disparou 8 . Em muitos países, HCQ ou CQ foram listados nas diretrizes de tratamento para COVID-19 (incluindo, por exemplo, China, Irlanda e Estados Unidos) 9 . Em uma coorte da cidade de Nova York de 1376 pacientes internados com COVID-19 durante março-abril de 2020, 59% receberam HCQ 10 . No entanto, o FDA revogou a autorização de uso de emergência em 15 de junho de 2020 11 . Nesse ponto, dois grandes ensaios clínicos randomizados (RCTs), RECOVERY e o ensaio WHO Solidarity, interromperam a inscrição em seus braços de tratamento de HCQ 12 , 13. Uma análise intermediária do estudo RECOVERY não mostrou nenhum benefício de mortalidade do HCQ 13 . Estabelecidos como tratamentos para malária e doenças reumáticas, HCQ e CQ podem acarretar efeitos adversos potencialmente graves, especialmente relacionados à arritmia cardíaca 6 . A incerteza pública ainda permanece, conforme ilustrado por relatórios recentes de uso planejado em epicentros de pandemia na América Central e do Sul 14 .
Enquanto muitos estudos estão em andamento, evidências publicadas adicionais de benefícios ou danos potenciais podem demorar vários meses, se chegarem ao fim. Dada a falta de resultados favoráveis no grande estudo RECOVERY e na revogada Autorização de Uso de Emergência, o recrutamento para estudos HCQ e CQ tornou-se cada vez mais difícil e muitos estudos podem correr o risco de terminar em futilidade. Um exame rápido dos dados sobre mortalidade por todas as causas do maior número possível de ensaios pode oferecer a melhor evidência sobre os benefícios potenciais de sobrevida e garantir que os pacientes não sejam expostos a riscos desnecessários se o benefício estiver ausente. Usamos a infraestrutura estabelecida com COVID-Evidence 15, um banco de dados abrangente de ensaios COVID-19 financiado pela Swiss National Science Foundation, para convidar todos os investigadores de ensaios HCQ ou CQ a participarem de uma meta-análise colaborativa internacional. Nosso objetivo foi identificar e combinar todos os ensaios clínicos randomizados que investigam os efeitos do HCQ ou CQ na mortalidade por todas as causas em pacientes com COVID-19 em comparação com qualquer braço de controle semelhante ao braço experimental em todos os aspectos, exceto a administração de HCQ ou CQ.
Neste trabalho, descobrimos que o tratamento com HCQ está associado ao aumento da mortalidade em pacientes com COVID-19, e não há benefício do CQ. Os resultados têm generalização pouco clara para pacientes ambulatoriais, crianças, mulheres grávidas e pessoas com comorbidades.
Resultados
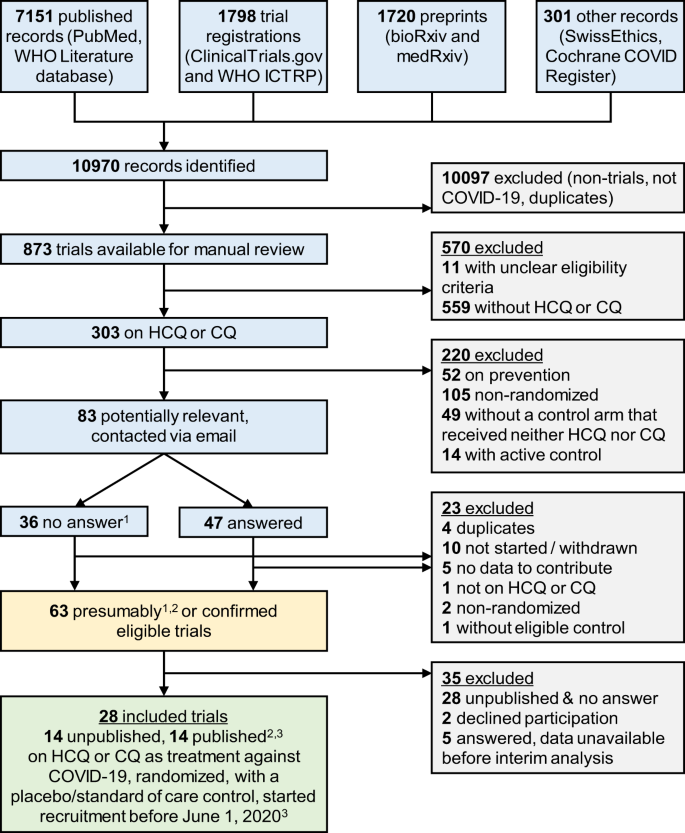
Nossa pesquisa identificou 146 ensaios clínicos randomizados investigando HCQ ou CQ como tratamento para COVID-19, dos quais 83 foram considerados potencialmente elegíveis após análise das comparações randomizadas. Os investigadores desses 83 estudos foram contatados e 57% (47 de 83) responderam (Fig. 1 ). Dos respondentes, 19 estudos eram elegíveis e estavam disponíveis (14 não publicados, um pré-impresso e quatro publicações); 21 ensaios foram inelegíveis de acordo com as informações fornecidas; cinco equipes de investigadores respondentes ainda não estavam prontas para compartilhar seus resultados; e dois diminuíram a participação. Para os 36 ensaios sem resposta, seis foram confirmados como elegíveis e disponíveis (quatro publicações e dois preprints); dois foram confirmados como inelegíveis; e para os 28 restantes, os resultados não estavam disponíveis, nem podiam ser confirmados como elegíveis.
Fontes pesquisadas até 11 de junho de 2020 (PubMed, ClinicalTrials.gov, WHO ICTRP, Cochrane COVID Register) ou 9 de abril (WHO Literature database, bioRxiv, medRxiv, SwissEthics). 1 Testes para os quais não recebemos resposta foram considerados elegíveis, a menos que sejam retirados. 2 Uma publicação e dois preprints foram identificados em uma atualização de pesquisa posterior. 3 Artigos publicados com revisão por pares ou pré-impressos postados. CQ cloroquina, HCQ hidroxicloroquina, ICTRP International Clinical Trials Registry Platform, Organização Mundial da Saúde da OMS.
Incluímos 28 ensaios (14 ensaios não publicados, nove publicações e cinco pré-impressos; destes, uma publicação e dois pré-impressos foram identificados pela primeira vez em nossa atualização de pesquisa) 13 , 16 , 17 , 18 , 19 , 20 , 21 , 22 , 23 , 24 , 25 , 26 , 27 , 28 . As características individuais dos estudos são apresentadas na Tabela 1 (28 estudos incluídos) e na Tabela Suplementar S1(34 potencialmente elegíveis, mas indisponíveis). No geral, as características dos estudos não foram diferentes entre os estudos incluídos e não disponíveis (Tabela 2 ).
O HCQ foi avaliado em 26 estudos (10.012 pacientes) e o CQ foi avaliado em quatro estudos (307 pacientes). Dois estudos investigaram tanto HCQ contra controle e CQ contra controle (63 pacientes). O tamanho médio da amostra foi de 95 (intervalo interquartil (IQR) 28–282) para os ensaios HCQ e 42 (IQR 29–95) para os ensaios CQ. Os dois maiores estudos (RECOVERY e WHO SOLIDARITY) incluíram 47% e 19% de todos os pacientes nos estudos HCQ, respectivamente. A maioria dos estudos investigou HCQ ou CQ em pacientes hospitalizados (22 estudos; 79%), e apenas cinco estudos (18%) tiveram um ambiente ambulatorial. A mortalidade média foi de 10,3% (desvio padrão 13,5%) em estudos com pacientes internados e 0,08% (desvio padrão 0,18%) nos estudos com pacientes externos. O comparador foi em 11 estudos com placebo (39%) e em 17 (61%) nenhum outro tratamento além do padrão. Na maioria das tentativas, 2 ). Não identificamos nenhum risco relevante de viés em todos os ensaios, com apenas um ensaio incluindo sete pacientes com um alto risco geral de viés (Tabela S2 ). Não encontramos evidências de efeitos de pequenos estudos (Figura S1 ).
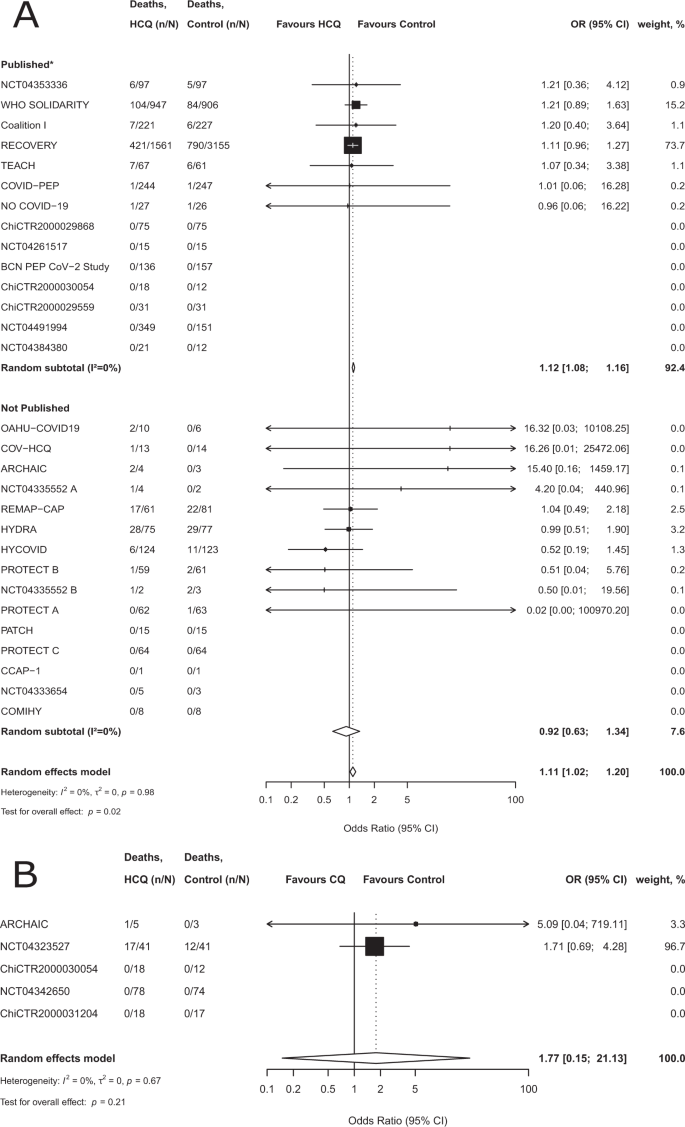
Em relação ao HCQ, nos 26 estudos incluídos, 606 de 4316 (14,0%) pacientes tratados com HCQ morreram e 960 de 5696 pacientes (16,9%) nos grupos de controle morreram (em 19 estudos com uma proporção de randomização de 1: 1, 7,7% de pacientes no braço HCQ morreram [181 de 2346] e 7,1% dos pacientes no braço de controle morreram [168 de 2352]). Na meta-análise, o odds ratio (OR) combinado foi 1,11 (intervalo de confiança de 95% (IC), 1,02-1,20, p = 0,02), com baixa heterogeneidade ( I 2 = 0%) (Fig. 2A ). Em 12 ensaios, incluindo um total de 1282 pacientes (representando 12,8% do tamanho total da amostra para HCQ), houve zero mortes em ambos os braços.
Uma meta-análise de efeitos aleatórios para mortalidade para o tratamento de COVID-19 com hidroxicloroquina, os ensaios são estratificados por status de publicação. A linha vertical tracejada denota uma razão de chances de 1,0, que não representa nenhuma diferença no risco entre a hidroxicloroquina e o controle. As barras horizontais pretas representam intervalos de confiança (ICs) de 95%. O modelo de efeitos aleatórios da abordagem de Hartung – Knapp – Sidik – Jonkman foi realizado para obter uma estimativa combinada da razão de chances. A estimativa da heterogeneidade ( τ 2 ) foi obtida usando o estimador de Paule e Mandel (PM). Descrevemos a heterogeneidade entre os ensaios usando a estatística I 2 . Os resultados dos testes estatísticos para o efeito geral e p correspondenteos valores são apresentados. Todos os testes foram bicaudais. * Publicado como artigos revisados por pares ou pré-impressos postados. B Meta-análise de efeitos aleatórios para mortalidade no tratamento de COVID-19 com cloroquina. A linha vertical tracejada denota uma razão de chances de 1,0, que não representa nenhuma diferença no risco entre a cloroquina e o controle. As barras horizontais pretas representam intervalos de confiança (ICs) de 95%. O modelo de efeitos aleatórios da abordagem de Hartung – Knapp – Sidik – Jonkman foi realizado para obter uma estimativa combinada da razão de chances. A estimativa da heterogeneidade ( τ 2 ) foi obtida usando o estimador de Paule e Mandel (PM). Descrevemos a heterogeneidade entre os ensaios usando o I 2estatística. Os resultados dos testes estatísticos para o efeito global e os valores de p correspondentes são apresentados. Todos os testes foram bicaudais. As escalas do eixo x diferem por razões de legibilidade. Os dados de origem são fornecidos como um arquivo de dados de origem .
Com relação ao CQ, nos quatro estudos incluídos, 18 de 160 (11%) pacientes tratados com CQ morreram e 12 de 147 pacientes (8%) nos grupos de controle morreram. O OR combinado foi 1,77 (IC 95% 0,15–21,13, p = 0,21), com baixa heterogeneidade ( I 2 = 0%) (Fig. 2B ). Em dois dos quatro ensaios, incluindo um total de 217 pacientes, houve zero mortes em ambos os braços.
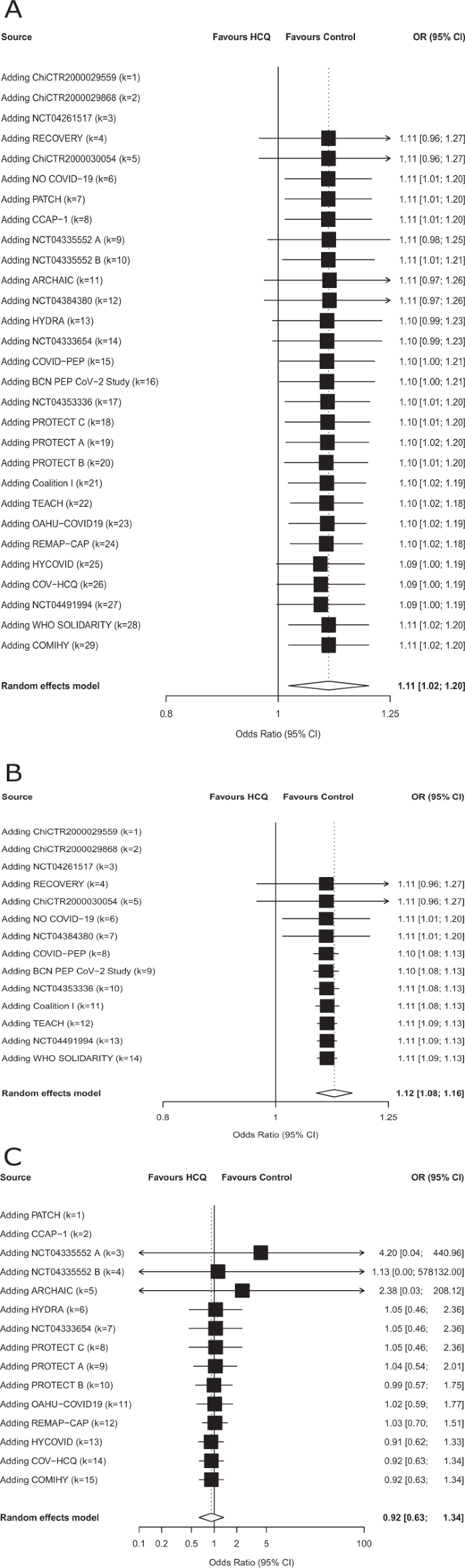
A evidência disponível neste estudo é o resultado de publicações, pré-impressões ou resultados de ensaios não publicados acumulados de 10 de abril de 2020 a 16 de outubro de 2020, conforme mostrado nas meta-análises cumulativas (Fig. 3A-C ).
Uma meta-análise cumulativa para mortalidade para o tratamento de COVID-19 com hidroxicloroquina. O HCQ foi avaliado em 26 estudos com 10.012 pacientes. Quatro mil trezentos e dezesseis pacientes foram tratados com hidroxicloroquina, dos quais 606 morreram. Cinco mil seiscentos e noventa e seis pacientes foram alocados para o grupo controle, dos quais 960 morreram. A linha vertical tracejada denota uma razão de chances de 1,0, que não representa nenhuma diferença no risco entre a hidroxicloroquina e o controle. As barras horizontais pretas representam intervalos de confiança (ICs) de 95%. O modelo de efeitos aleatórios da abordagem de Hartung – Knapp – Sidik – Jonkman foi realizado para obter uma estimativa combinada da razão de chances. A estimativa da heterogeneidade ( τ 2) foi obtido usando o estimador de Paule e Mandel (PM). Descrevemos a heterogeneidade entre os ensaios usando a estatística I 2 . Os resultados dos testes estatísticos para o efeito global e os valores de p correspondentes são apresentados. Todos os testes foram bicaudais. BMeta-análise cumulativa para mortalidade para o tratamento de COVID-19 com hidroxicloroquina (publicações e preprints apenas). O HCQ foi avaliado em 14 estudos publicados com 8.981 pacientes. Três mil oitocentos e nove pacientes foram tratados com hidroxicloroquina, dos quais 547 morreram. Cinco mil cento e setenta e dois pacientes foram alocados para o grupo de controle, dos quais 893 morreram. A linha vertical tracejada denota uma razão de chance de 1,0, que representa nenhuma diferença no risco entre a hidroxicloroquina e o controle. As barras horizontais pretas representam intervalos de confiança (IC) de 95%. O modelo de efeitos aleatórios da abordagem de Hartung – Knapp – Sidik – Jonkman foi realizado para obter uma estimativa combinada da razão de chances. A estimativa da heterogeneidade ( τ 2) foi obtido usando o estimador de Paule e Mandel (PM). Descrevemos a heterogeneidade entre os ensaios usando a estatística I 2 . Os resultados dos testes estatísticos para o efeito global e os valores de p correspondentes são apresentados. Todos os testes foram bicaudais. CMeta-análise cumulativa para mortalidade para o tratamento de COVID-19 com hidroxicloroquina (dados não publicados apenas). O HCQ foi avaliado em 12 ensaios não publicados com 1.031 pacientes. Quinhentos e sete pacientes foram tratados com hidroxicloroquina, dos quais 59 morreram. Quinhentos e vinte e quatro pacientes foram alocados para o grupo controle, dos quais 67 morreram. A linha vertical tracejada denota uma razão de chances de 1,0, que não representa nenhuma diferença no risco entre a hidroxicloroquina e o controle. As barras horizontais pretas representam intervalos de confiança (ICs) de 95%. O modelo de efeitos aleatórios da abordagem de Hartung – Knapp – Sidik – Jonkman foi realizado para obter uma estimativa combinada da razão de chances. A estimativa da heterogeneidade ( τ 2) foi obtido usando o estimador de Paule e Mandel (PM). Descrevemos a heterogeneidade entre os ensaios usando a estatística I 2 . Os resultados dos testes estatísticos para o efeito global e os valores de p correspondentes são apresentados. Todos os testes foram bicaudais. As escalas do eixo x diferem por razões de legibilidade. Os dados de origem são fornecidos como um arquivo de dados de origem .
Para HCQ, nenhuma das análises exploratórias de subgrupos mostrou uma modificação de efeito (Suplemento Tabela S3 e Figura S1A, B ). Ao incluir apenas informações publicadas (publicações e pré-impressões, excluindo ensaios não publicados), houve um aumento na mortalidade entre os pacientes tratados com HCQ (OR 1,12, IC 95% 1,08-1,16), enquanto entre os ensaios não publicados não houve tal sinal de aumento mortalidade (OR 0,92, IC 95% 0,63-1,34, p para interação = 0,23). Não conduzimos análises de subgrupos para CQ, pois havia apenas dois ensaios com eventos. Nas análises de sensibilidade empregando diferentes abordagens meta-analíticas (Suplemento Tabela S4 e Figuras S2A-C ), os resultados foram compatíveis com a análise principal.
Discussão
Esta meta-análise colaborativa de 28 ensaios clínicos randomizados publicados ou não publicados, incluindo 10.319 pacientes, mostra que o tratamento com HCQ foi associado ao aumento da mortalidade em pacientes com COVID-19 e não houve benefício do tratamento com CQ. Não foram observadas diferenças nas análises de subgrupos na configuração do paciente, confirmação do diagnóstico, tipo de controle, status da publicação ou dose e a heterogeneidade entre os estudos foi baixa. Para CQ, o número de estudos era muito pequeno para tirar conclusões claras.
Esta meta-análise oferece informações úteis para uma situação de saúde desafiadora. Centenas de milhares de pacientes receberam HCQ e CQ fora dos ensaios clínicos, sem evidências de seus efeitos benéficos. O interesse público é sem precedentes, com evidências iniciais fracas que apoiam os méritos do HCQ sendo amplamente discutidas em algumas mídias e redes sociais - apesar dos resultados desfavoráveis de um grande RCT. Numerosos estudos clínicos têm investigado HCQ e CQ quase simultaneamente. Embora várias revisões sistemáticas e metanálises já estejam disponíveis, elas consideram apenas o pequeno punhado de RCTs já publicados (que foram todos incluídos aqui) 29 , 30 , 31 , 32 , 33. Embora o compartilhamento de dados tenha sido bastante limitado até o momento na pesquisa biomédica, essa abertura pode ser transformadora na geração de conhecimento. Esta pandemia reuniu uma colaboração de pesquisadores clínicos concordando em compartilhar seus dados, o que permite que este estudo não apenas resuma as evidências existentes, mas também ilustre o acúmulo de evidências que de outra forma não estariam disponíveis.
Para o HCQ, a evidência é dominada pelo estudo RECOVERY 13 , que não indicou nenhum benefício na mortalidade para pacientes tratados com COVID-19, juntamente com hospitalização mais longa e maior risco de progressão para ventilação mecânica invasiva e / ou morte. Da mesma forma, o estudo WHO SOLIDARITY não indicou nenhum benefício na mortalidade 26 . Os estudos RECOVERY e WHO SOLIDARITY usaram HCQ em doses comparativamente mais altas do que todos os outros estudos, exceto REMAP-CAP. Não houve evidência de uma modificação de efeito por dose ( p para interação = 0,29), e o efeito combinado de todos os ensaios com dose mais baixa não indicou um benefício de HCQ, mas tendeu a um efeito nulo (OR 0,97; 0,73-1,30) com amplos CIs, compatível com a estimativa do efeito principal.
Esta meta-análise não aborda o uso profilático nem outros resultados além da mortalidade. Todos os estudos, exceto três, excluíram crianças e a maioria excluiu mulheres grávidas ou amamentando; a generalização permanece obscura para essas populações. Entre os cinco estudos em pacientes ambulatoriais, houve três mortes, duas ocorrendo em um ensaio de 491 pacientes relativamente jovens com poucas comorbidades 17 e uma ocorrendo em um pequeno ensaio com 27 pacientes. Para pacientes ambulatoriais idosos ou com comorbidades, as evidências são esparsas. A maioria dos 28 estudos excluiu pessoas com comorbidades com maior risco de eventos adversos de HCQ ou CQ 16 , 17 , 27. Nenhuma evidência está a caminho para esses grupos, o que ecoa o raciocínio clínico relutante em expô-los ao risco.
Embora os estudos publicados tenham resultado em uma estimativa de tratamento conclusiva, os estudos não publicados tendem a ter um efeito nulo. A tendência dos ensaios publicados de relatar tamanhos de efeito maiores do que os ensaios não publicados está bem documentada e constitui um dos vieses de relato que são discerníveis apenas quando um corpo de estudos é considerado em conjunto 34 . É menos provável que resultados nulos sejam disseminados rapidamente, especialmente se o estudo for pequeno. Digno de nota, os resultados da RECUPERAÇÃO mostrando os benefícios da dexametasona foram publicados mais rapidamente 3 do que os resultados desfavoráveis do HCQ 13. Não encontramos nenhuma evidência para efeitos de pequenos estudos e consideramos que os resultados provavelmente não foram afetados materialmente por viés de publicação ou relatório. Este artigo oferece o resumo mais abrangente sobre HCQ e mortalidade em COVID-19 até o momento.
Vinte e três por cento dos ensaios potencialmente elegíveis foram listados como descontinuados, principalmente por causa de menos pacientes do que o esperado. Entre 28 ECRs incluídos, apenas dois haviam atingido seu tamanho de amostra alvo no momento da censura para esta meta-análise. Conforme discutido anteriormente 4 , a maioria dos ensaios em HCQ e CQ em COVID-19 são pequenos, refletindo a forte motivação para esforços individuais e enfatizando a necessidade de infraestrutura de pesquisa prontamente disponível para fundir iniciativas de pequena escala. Especialmente no contexto de desafios de recrutamento, encorajamos outros pesquisadores a formar colaborações e combinar os resultados dos ensaios 35 .
Nossa análise tem algumas limitações. Em primeiro lugar, embora tenhamos adotado uma estratégia de busca abrangente e sistemática, nossa iniciativa em tempo real difere das revisões sistemáticas tradicionais. Nós nos concentramos na coleta de informações não publicadas, com o objetivo de garantir rapidamente o máximo possível de evidências de julgamento. Não revisamos os estudos individuais, nem estratificamos os resultados de acordo com as características do paciente, e não coletamos informações sobre outros resultados além da mortalidade. Tais análises são planejadas em publicações futuras usando detalhes detalhados divulgados em publicações de ensaios individuais futuras 36 , 37 , 38 . As análises exploratórias de subgrupos não apoiaram a hipótese de que o cegamento / uso de placebo está associado ao efeito observado (o teste para uma interação dáp = 0,15 e o OR é 0,88 com ICs amplos 0,55-1,41, compatível com o efeito geral); além disso, o desgaste foi insignificante (mediana 0%, IQR 0–0%; intervalo 0–19,5%). Um estudo metaepidemiológico mostra poucas evidências de que os resultados de mortalidade seriam afetados por falta de cegamento ou problemas de randomização e ocultação de alocação, em contraste com resultados menos objetivos 39. Consequentemente, não identificamos nenhum risco relevante de viés entre os ensaios. Em segundo lugar, a maioria dos ensaios potencialmente elegíveis não estava disponível. Apesar de ir muito além da revisão padrão das evidências publicadas, esperamos resultados adicionais de estudos futuros sobre CQ para estreitar a incerteza do efeito do tratamento e, possivelmente, revelar benefícios ou danos não discerníveis com base nas evidências atuais. Planejamos realizar uma atualização quando evidências adicionais substanciais estiverem disponíveis. Terceiro, embora esta análise pretendesse combinar os resultados de pacientes internados e ambulatoriais, independentemente da gravidade da doença, os ensaios clínicos envolvendo pacientes com doença leve a moderada constituíram uma minoria do tamanho final da amostra; muitos dos quais tiveram nenhum ou poucos eventos. Finalmente,estimador τ 2 ) rendeu CIs substancialmente mais amplos. Esta combinação deu peso desproporcionalmente baixo para RECUPERAÇÃO (15%) e consideramos o modelo principal (HKSJ com estimador PM τ 2 ) mais válido nesta situação.
O tratamento com HCQ para COVID-19 foi associado ao aumento da mortalidade, e não houve benefício do CQ com base nos dados de estudos randomizados atualmente disponíveis. Os profissionais médicos em todo o mundo são incentivados a informar os pacientes sobre essas evidências.
Métodos
Esta meta-análise colaborativa focou exclusivamente na mortalidade por todas as causas, a fim de fornecer evidências rápidas sobre o resultado clínico mais crítico. Os investigadores de estudos em andamento, descontinuados ou concluídos foram contatados por e-mail para fornecer dados de mortalidade em nível de grupo (agregados) por braço do estudo em qualquer momento disponível. O protocolo foi publicado online antes da coleta de dados 40 . Esta revisão foi relatada de acordo com os Itens de Relatório Preferidos para Revisão Sistemática e Meta-análise 41 . O checklist PRISMA pode ser encontrado no suplemento (Suplemento 1 ).
Critérios de elegibilidade
Foram considerados todos os ensaios clínicos que relataram a alocação aleatória de pacientes com infecção confirmada ou suspeita de SARS-CoV-2 para um protocolo de tratamento contendo HCQ ou CQ (para qualquer duração ou dose) ou o mesmo protocolo de tratamento não contendo HCQ ou CQ. Em outras palavras, o grupo de controle teve que receber placebo ou nenhum tratamento além do padrão de atendimento (excluímos comparações de HCQ ou CQ contra um tratamento ativo, por exemplo, HCQ versus azitromicina, uma vez que os controles ativos eram muito heterogêneos para agrupar e revelar o benefícios e danos puros de HCQ ou CQ). Ensaios clínicos em andamento elegíveis tinham que fornecer dados sobre todas as causas de mortalidade e randomizar o primeiro paciente antes de 1º de junho de 2020 (momento selecionado arbitrariamente, pois não esperávamos ensaios lançados posteriormente para recrutar pacientes suficientes para fornecer informações adicionais relevantes). Os ensaios que foram publicados ou postados como pré-impressão não eram restritos por data. Os ensaios de prevenção não foram incluídos. Incluímos ensaios independentemente do tempo de acompanhamento e se a mortalidade foi um desfecho primário ou não; além disso, não colocamos restrições ao status do estudo, idioma, região geográfica ou ambiente de saúde.
Estratégia de pesquisa
Procuramos por estudos elegíveis registrados em ClinicalTrials.gov e na Plataforma Internacional de Registro de Ensaios Clínicos da OMS (ICTRP) até 11 de junho de 2020 (banco de dados de evidências COVID; ver Suplemento 2 ) 42 . Além disso, pesquisamos no PubMed e no registro de estudos Cochrane COVID-19 (cobrindo pré-impressões, registros de estudos e bancos de dados de literatura) até 11 de junho de 2020, usando termos relacionados a HCQ e CQ combinados com termos para COVID-19 e um filtro RCT padrão (Suplemento 2 ) 43 . Atualizamos a pesquisa bibliográfica em 16 de outubro de 2020. Dois autores (CA e AMS) verificaram independentemente os critérios de elegibilidade (Fig. 1 ) e resolveram quaisquer discrepâncias por discussão.
Os investigadores principais de 83 ensaios potencialmente elegíveis foram solicitados a confirmar os critérios de elegibilidade, bem como: “Para cada um dos braços do seu estudo: (a) Que intervenção este grupo recebeu? (b) Quantos pacientes foram randomizados para este grupo? (c) Desses pacientes, quantos morreram? (d) Destes pacientes, para quantos não se sabe se estão vivos ou mortos? ” (Suplemento 3 , modelo de email). Os investigadores que não responderam receberam dois lembretes por e-mail em inglês ou chinês, dependendo da origem do estudo.
Extração de dados
As seguintes informações foram extraídas de todos os RCTs incluídos por dois revisores (CA e AMS) e verificadas pelos investigadores do ensaio: braços experimentais e de controle, número de participantes randomizados, cronograma de tratamento, configuração do paciente, critérios de elegibilidade, local do estudo, cegamento, amostra-alvo tamanho e status do teste. Também classificamos os ensaios como publicados em um periódico revisado por pares, postados em um servidor de pré-impressão ou não publicados (a última categoria não inclui pré-impressões). Por razões de viabilidade dentro desta avaliação rápida, geralmente não solicitamos informações descritivas além dos itens incluídos nos registros do ensaio.
Avaliação de risco de viés
Dois revisores (CA e AMS) avaliaram independentemente o risco de viés de RCTs incluídos usando a ferramenta Cochrane de risco de viés 2.0 44 . As discordâncias foram resolvidas por meio de discussão. Usamos as informações relatadas em preprints e publicações em periódicos e, para estudos não publicados, recuperamos informações dos registros do estudo, que foram confirmadas pelos investigadores do estudo. Também avaliamos os efeitos de pequenos estudos com um gráfico de funil invertido e o teste de Egger 43 . A presença de efeitos de pequenos estudos pode ser sugestiva, mas não definitiva, de viés de publicação 45 .
Síntese e análise de dados
A análise principal avaliou separadamente o efeito sobre a mortalidade por todas as causas de HCQ versus controle e CQ versus controle. Relatamos números absolutos e proporções, bem como a estimativa do efeito do tratamento como um odds ratio (OR; chance de morte no grupo de intervenção HCQ ou CQ dividido pela chance de morte no grupo de controle) com IC de 95%. Para estudos com vários braços, solicitamos dados para todos os braços e calculamos as estimativas do efeito do tratamento para cada comparação elegível. Combinamos os efeitos da mortalidade de todos os ensaios clínicos randomizados com base em dados binários de resultados (tabelas de contingência 2 × 2) em metanálises e descrevemos a heterogeneidade estatística usando a estatística I 2 46 . Em nosso protocolo, nós pré-especificamos um modelo de efeitos aleatórios da abordagem de Hartung – Knapp – Sidik – Jonkman (HKSJ) 47, a fim de fornecer mais igualdade de pesos entre ensaios com tamanho moderado a grande (do que, por exemplo, a abordagem DerSimonian-Laird). Não pré-especificamos o estimador de variância entre os estudos, τ 2 , mas escolhemos o estimador de Paule e Mandel (PM) com base na orientação fornecida na escolha entre 16 variantes 48 . Casos de zero eventos em um braço foram corrigidos adicionando o recíproco do tamanho do braço de estudo contrastante 43. No entanto, considerando a gama de tamanhos de amostra e o número de zero eventos entre os ensaios, avaliamos os efeitos de abordagens alternativas com análises de sensibilidade, conforme detalhado abaixo. Para explorar e ilustrar a geração de evidências ao longo do tempo, também realizamos uma meta-análise cumulativa de todos os ensaios, bem como estratificada por status de disseminação (publicações / pré-impressões versus não publicadas), usando a abordagem HKSJ com PM τ 2 . Usamos a data de resposta do e-mail ou publicação / postagem de pré-impressão. As meta-análises foram concluídas usando R versão 3.5.1 e o pacote “meta” versão 4.13-0.
Análises de subgrupo
Em análises exploratórias de subgrupos, estratificamos os ensaios por configuração do paciente (como proxy para a gravidade do COVID-19: pacientes ambulatoriais, pacientes internados, mas não unidade de terapia intensiva (UTI) e UTI), confirmação diagnóstica (SARS-CoV-2 confirmado versus casos suspeitos), tipo de controle (controle de placebo versus outro) e publicações / pré-impressões versus ensaios não publicados. Não estratificamos os dados ausentes, pois a quantidade era extremamente baixa. Uma estratificação post hoc por dose de HCQ foi adicionada (ensaios com ≥1600 mg no dia 1 e ≥800 mg no dia 2 versus ensaios de dose mais baixa) para isolar os ensaios previstos para atingir níveis sanguíneos de HCQ acima da metade da concentração inibitória máxima in vitro valor para SARS-CoV-2 (1,13 μM) 49 .
Análises de sensibilidade
Adicionamos análises de sensibilidade exploratórias para avaliar a robustez através de abordagens meta-analíticas: estimadores DerSimonian-Laird e Sidik-Jonkman τ 2 , método de efeitos aleatórios de Mantel-Haenszel e método de Peto. DerSimonian – Laird é uma abordagem de meta-análise de efeitos aleatórios padrão, mas pode subestimar a incerteza. O estimador Sidik-Jonkman τ 2 , por outro lado, pode produzir estimativas infladas se a heterogeneidade for baixa 48. O método Mantel-Haenszel funciona razoavelmente bem com contagens de eventos pequenos e zero, muito parecido com a transformação de Peto e arco seno. O método de Peto é subótimo na presença de desequilíbrios substanciais na proporção de alocação de pacientes randomizados nos braços comparados (por exemplo, estudo RECOVERY). Também modelamos variantes para lidar com zero eventos (diferença de arco e excluindo tentativas com zero eventos), bem como excluindo tentativas com <50 participantes.
Detalhes de testes não publicados
Todos os ensaios não publicados foram realizados de acordo com os princípios da Declaração de Helsinque e o consentimento informado por escrito foi obtido dos participantes do estudo. A divulgação dos dados do desfecho de mortalidade foi autorizada pelos respectivos comitês de monitoramento de dados e segurança e investigadores principais. A aprovação ética foi concedida pelos conselhos de revisão institucional da seguinte forma: University of Pennsylvania, ref. # 842838 (PATCH, NCT04329923); Comitê Nacional de Bioética (NBC) Paquistão, ref. 4–87 / NBC-471-COVID-19-05 / 20 / (PROTECT, NCT04338698); Comitê de Ética da Região da Capital da Dinamarca, ref. H-20025317 (CCAP-1, NCT04345289); Comité de Protection des Personnes du Sud-Ouest et Outre-Mer 4, ref. CPP2020-03-036 / 2020-001271-33 / 20.03.24.72431, e a Agence Nationale de Sécurité du Médicament et des produits de santé (ANSM), ref. MEDAECNAT-2020-03-00045 (HYCOVID, NCT04325893); Ethik-Kommission an der Medizinischen Fakultät der Eberhard-Karls-Universität und am Universitätsklinikum Tübingen, ref. 190 / 2020AMG1 e ref. 225 / 2020AMG1 (COV-HCQ, NCT04342221; e COMIHY, NCT04340544, respectivamente); Comitê de Ética em Pesquisa da London-Surrey Borders no Reino Unido, Medisch Ethische Toetsingscommissie Utrecht (METC Utrecht) na Holanda, Comitê de Revisão de Ética no Distrito Local de Sydney (Royal Prince Alfred Hospital) na Austrália, Comitê de Ética em Saúde e Deficiência Northern A na Nova Zelândia, St . Comitê de Ética e Pesquisa Médica do Grupo de Saúde de Vincent na Irlanda, Comitê de Revisão Institucional do King Abdullah International Medical Research Center na Arábia Saudita, Comitê de Revisão Institucional da Universidade de Pittsburgh nos Estados Unidos, Comitê de Ética em Pesquisa da Unidade de Saúde no Canadá, Comité Nacional de Ética para a Investigação Clínica (CEIC), em Portugal, e Comité Nacional de Bioética da Academia de Ciências Médicas da Roménia para os Medicamentos e Dispositivos Médicos (REMAP-CAP, NCT02735707); Comissão Nacional de Ética em Pesquisa (CONEP), ref. 3.961.681 (CloroCOVID19II A, NCT04323527 e CloroCOVID19II B, NCT04342650); uma Comissão Única de Ética da Coordenação dos Institutos Nacionais de Saúde e Hospitais de Alta Especialidade, ref. C13-20 (HYDRA, NCT04315896); o Comitê de Ética do Hospital Beijing Youan, Capital Medical University, ref. JINYOUKELUN [2020] 013 (ChiCTR2000031204); Comitê de Pesquisa Humana de Parceiros no Hospital Brigham and Women's, Boston, Ethisch Comite na Bélgica, e Stichting Beoordeling Ethiek Biomedisch na Holanda (NCT04333654); Centro Médico da Rainha, ref. RA-2020-018 (OAHU-COVID19, NCT04345692); Conselho de Revisão Institucional do Duke University Medical Center, ref. Pro00105339 e Conselho de Revisão Institucional de Saúde UnityPoint (NCT04335552); e Comitê de Ética Médica de Utrecht (METC Utrecht), parte do Comitê Central Holandês de Pesquisa Envolvendo Seres Humanos (ARCHAIC, NL8490).
Resumo do relatório
Mais informações sobre o desenho da pesquisa estão disponíveis no Nature Research Reporting Summary vinculado a este artigo.
Disponibilidade de dados
Todos os dados de nível de ensaio gerados ou analisados durante este estudo estão incluídos neste artigo publicado e seus arquivos de informações suplementares. O arquivo de dados é fornecido no Open Science Framework [ https://osf.io/qesv4/ ] 40 . Os dados de origem são fornecidos com este documento.
Disponibilidade de código
O arquivo de código é fornecido no Open Science Framework [ https://osf.io/qesv4/ ] 40 .
Referências
- 1
Berlin, DA, Gulick, RM e Martinez, FJ Severe Covid-19. N. Engl. J. Med. https://doi.org/10.1056/NEJMcp2009575 (2020).
- 2
Centro de Recursos do Coronavírus Johns Hopkins. Mapa do covid19. https://coronavirus.jhu.edu/map.html (2020).
- 3
RECUPERAÇÃO Collaborative Group et al. Dexametasona em pacientes hospitalizados com Covid-19 - relatório preliminar. N. Engl. J. Med. https://doi.org/10.1056/NEJMoa202143 6 (2020).
- 4
Janiaud, P. et al. A resposta da pesquisa de ensaio clínico mundial à pandemia COVID-19 - os primeiros 100 dias. F1000Res. 9 , 1193 (2020).
- 5
Fantini, J., Di Scala, C., Chahinian, H. & Yahi, N. Estudos de modelagem estrutural e molecular revelam um novo mecanismo de ação da cloroquina e hidroxicloroquina contra a infecção por SARS-CoV-2. Int. J. Antimicrob. Agents 55 , 105960 (2020).
- 6
dos Reis Neto, ET et al. Revisitando hidroxicloroquina e cloroquina para pacientes com doenças reumáticas inflamatórias mediadas por imunidade crônica. Adv. Rheumatol. 60 , 32 (2020).
- 7
Gabinete do Comissário. Autorização de uso de emergência. US Food and Drug Administration . https://www.fda.gov/emergency-preparedness-and-response/mcm-legal-regulatory-and-policy-framework/emergency-use-authorization (2020).
- 8
Vaduganathan, M. et al. Padrões de preenchimento de prescrição para medicamentos comumente usados durante a pandemia de COVID-19 nos Estados Unidos. JAMA https://doi.org/10.1001/jama.2020.9184 (2020).
- 9
Dagens, A. et al. Escopo, qualidade e abrangência das diretrizes clínicas produzidas no início da pandemia covid-19: revisão rápida. BMJ 369 , m1936 (2020).
- 10
Geleris, J. et al. Estudo observacional de hidroxicloroquina em pacientes hospitalizados com Covid-19. N. Engl. J. Med. https://doi.org/10.1056/NEJMoa2012410 (2020).
- 11
Gabinete do Comissário. Atualização do coronavírus (COVID-19): FDA revoga a autorização de uso de emergência para cloroquina e hidroxicloroquina. US Food and Drug Administration . https://www.fda.gov/news-events/press-announcements/coronavirus-covid-19-update-fda-revokes-emergency-use-authorization-chloroquine-and (2020).
- 12
QUEM. A OMS interrompe os braços de tratamento com hidroxicloroquina e lopinavir / ritonavir para COVID-19. https://www.who.int/news-room/detail/04-07-2020-who-discontinues-hydroxychloroquine-and-lopinavir-ritonavir-treatment-arms-for-covid-19 (2020).
- 13
RECUPERAÇÃO Collaborative Group et al. Efeito da hidroxicloroquina em pacientes hospitalizados com Covid-19. N. Engl. J. Med. https://doi.org/10.1056/NEJMoa2022926 (2020).
- 14
Trigo, MS, Kurmanaev, A. & Cabrera, JML Com o apoio das autoridades, surgem remédios contra vírus duvidosos na América Latina. The New York Times (23 de julho de 2020).
- 15
Janiaud, P., Axfors, C., Saccilotto, R., Hemkens, L. & Schmitt, A. COVID-evidência: um banco de dados vivo de ensaios sobre intervenções para COVID-19. https://doi.org/10.17605/OSF.IO/GEHFX (2020).
- 16
Chen, L. et al. Eficácia e segurança da cloroquina ou hidroxicloroquina no tipo moderado de COVID-19: um estudo prospectivo aberto, randomizado e controlado. Pré- impressão em medRxiv https://doi.org/10.1101/2020.06.19.20136093 (2020).
- 17
Skipper, CP et al. Hidroxicloroquina em adultos não hospitalizados com COVID-19 precoce: um ensaio randomizado. Ann. Intern. Med. https://doi.org/10.7326/M20-4207 (2020).
- 18
Jun, C. et al. Um estudo piloto de hidroxicloroquina no tratamento de pacientes com COVID-19 moderado. J. Zhejiang Univ. 49 , 215-219 (2020).
- 19
Cavalcanti, AB et al. Hidroxicloroquina com ou sem azitromicina em Covid-19 leve a moderado. N. Engl. J. Med. https://doi.org/10.1056/NEJMoa2019014 (2020).
- 20
Mitjà, O. et al. Hidroxicloroquina para o tratamento precoce de adultos com Covid-19 leve: um ensaio clínico randomizado. Clin. Infectar. Dis. https://doi.org/10.1093/cid/ciaa1009 (2020).
- 21
Chen, Z. et al. Eficácia da hidroxicloroquina em pacientes com COVID-19: resultados de um ensaio clínico randomizado. Pré- impressão em medRxiv https://doi.org/10.1101/2020.03.22.20040758 (2020).
- 22
Chen, C.-P. et al. Um ensaio multicêntrico, randomizado, aberto e controlado para avaliar a eficácia e tolerabilidade da hidroxicloroquina e um estudo retrospectivo em pacientes adultos com doença coronavírus leve a moderada 2019 (COVID-19). Pré-impressão em medRxiv 2020.07.08.20148841 (2020).
- 23
Kamran, SM et al. Limpando a névoa: o HCQ é eficaz na redução da progressão do COVID-19: um ensaio clínico randomizado. Pré- impressão em medRxiv https://doi.org/10.1101/2020.07.30.20165365 (2020).
- 24
Ulrich, RJ et al. Tratando Covid-19 com hidroxicloroquina (TEACH): um estudo multicêntrico, duplo-cego, randomizado e controlado em pacientes hospitalizados. Open Forum Infect. Dis. https://doi.org/10.1093/ofid/ofaa446 (2020).
- 25
Abd-Elsalam, S. et al. Hidroxicloroquina no tratamento de COVID-19: um estudo multicêntrico randomizado controlado. Sou. J. Trop. Med. Hyg. https://doi.org/10.4269/ajtmh.20-0873 (2020).
- 26
OMS Solidarity Trial Consortium et al. Medicamentos antivirais reaproveitados para COVID-19; resultados provisórios do ensaio WHO SOLIDARITY. Pré- impressão em medRxiv https://doi.org/10.1101/2020.10.15.20209817 (2020).
- 27
Tang, W. et al. Hidroxicloroquina em pacientes com doença coronavírus principalmente leve a moderada 2019: ensaio aberto, randomizado controlado. BMJ 369 , m1849 (2020).
- 28
Lyngbakken, MN et al. Um ensaio clínico randomizado pragmático relatou falta de eficácia da hidroxicloroquina na cinética viral da doença coronavírus em 2019. Nat. Comum. 11 , 5284 (2020).
- 29
Siemieniuk, RA et al. Tratamentos medicamentosos para covid-19: revisão sistemática viva e meta-análise de rede. BMJ 370 , m2980 (2020).
- 30
Thoguluva Chandrasekar, V. et al. Revisão sistemática e meta-análise da eficácia das opções de tratamento contra a infecção por SARS-CoV-2. J. Med. Virol. https://doi.org/10.1002/jmv.26302 (2020).
- 31
Liu, W. et al. Eficácia e segurança do tratamento antiviral para COVID-19 a partir de evidências em estudos de SARS-CoV-2 e outras infecções virais agudas: uma revisão sistemática e meta-análise. CMAJ 192 , E734 – E744 (2020).
- 32
Hernandez, AV, Roman, YM, Pasupuleti, V., Barboza, JJ e Michael White, C. Hidroxicloroquina ou cloroquina para o tratamento ou profilaxia de COVID-19: uma revisão sistemática viva. Ann. Intern. Med. 173 , 287–296 (2020).
- 33
Sarma, P. et al. Cura virológica e clínica em pacientes COVID-19 tratados com hidroxicloroquina: uma revisão sistemática e meta-análise. J. Med. Virol. 92 , 776-785 (2020).
- 34
Dechartres, A., Atal, I., Riveros, C., Meerpohl, J. & Ravaud, P. Associação entre as características de publicação e estimativas de efeito de tratamento: um estudo metaepidemiológico. Ann. Intern. Med. 169 , 385–393 (2018).
- 35
Petkova, E., Antman, EM & Troxel, AB Pooling data from individual clínico tests in the COVID-19 era. JAMA https://doi.org/10.1001/jama.2020.13042 (2020).
- 36
Bravo-Jeria, R. et al. Cloroquina e hidroxicloroquina para o tratamento de COVID-19: uma revisão sistemática viva. PROSPERO 2020 CRD42020178195 . https://www.crd.york.ac.uk/prospero/display_record.php?RecordID=178195 (2020).
- 37
Scott, DA et al. Uma revisão sistemática e meta-análise da eficácia e segurança da cloroquina para o tratamento de pacientes com COVID-19. PROSPERO 2020 CRD42020178266 . https://www.crd.york.ac.uk/prospero/display_record.php?RecordID=178266 (2020).
- 38
Fontes, LE et al. Cloroquina / hidroxicloroquina para doença coronavírus 2019 (COVID-19) - uma revisão sistemática dos dados individuais dos participantes. PROSPERO 2020 CRD42020178667 . https://www.crd.york.ac.uk/prospero/display_record.php?ID=CRD42020178667 (2020).
- 39
Savović, J. et al. Influência das características do desenho do estudo relatado nas estimativas do efeito da intervenção de ensaios clínicos randomizados e controlados. Ann. Intern. Med. 157 , 429–438 (2012).
- 40
Axfors, C. et al. Hidroxicloroquina e cloroquina para sobrevivência em COVID-19: uma meta-análise colaborativa internacional de ensaios clínicos randomizados. Open Science Framework. https://doi.org/10.17605/OSF.IO/QESV4 (2020).
- 41
Page, MJ et al. A declaração PRISMA 2020: uma diretriz atualizada para relatar revisões sistemáticas. Pré- impressão em MetaArXiv https://doi.org/10.31222/osf.io/v7gm2 (2020).
- 42
A equipe COVID-Evidence. COVID-evidência. https://covid-evidence.org/ (2020).
- 43
Higgins, JPT et al. Cochrane Handbook for Systematic Reviews of Interventions (Wiley, 2019).
- 44
Sterne, JAC et al. RoB 2: uma ferramenta revisada para avaliar o risco de viés em estudos randomizados. BMJ 366 , l4898 (2019).
- 45
Sterne, JAC et al. Recomendações para examinar e interpretar a assimetria do gráfico de funil em meta-análises de ensaios clínicos randomizados. BMJ 343 , d4002 (2011).
- 46
Higgins, JPT, Thompson, SG, Deeks, JJ & Altman, DG Measuring inconsistency in meta-analysis. BMJ 327 , 557–560 (2003).
- 47
IntHout, J., Ioannidis, JPA & Borm, GF O método Hartung-Knapp-Sidik-Jonkman para meta-análise de efeitos aleatórios é direto e supera consideravelmente o método DerSimonian-Laird padrão. BMC Med. Res. Methodol. 14 , 25 (2014).
- 48
Veroniki, AA et al. Métodos para estimar a variância entre os estudos e sua incerteza na meta-análise. Res. Synth. Methods 7 , 55-79 (2016).
- 49
White, NJ et al. Prevenção e tratamento com COVID-19: uma análise crítica da farmacologia clínica da cloroquina e da hidroxicloroquina. PLoS Med. 17 , e1003252 (2020).
Reconhecimentos
Desejamos expressar nossa sincera gratidão a todos os pacientes que se ofereceram para os estudos envolvidos. Além disso, agradecemos a Wenyan Ma e Benjamin Kasenda (University Hospital Basel, University of Basel) por gentilmente traduzirem os e-mails para os investigadores chineses. Por contribuições valiosas para testes individuais neste grupo colaborativo, agradecemos sinceramente: Hannah Jin, Monica Feeley, Bruce Bausk, Jessica Cauley, Jane Kleinjan, Jon Gothing, Naeema Bangash, Heather Wroe, Claire Bigogne, Christelle Castell, Annelies Mottart, Lisette Cortenraad , Judith Medema-Muller, Katia Handelberg, Khalid Benhammou, Shaheen Kumar, Sophie Gribomont, Kim Kuehne, Cathia Markina, Julien Labeirie, Julie Pencole, Eva Crispyn, Cecile Le Breton, Kelli Horn, Tina Patel, Benjamin Harwares, Isabelle Collin, Vethees Manivannan, Irma Slomp, Frederick Becue, Isabelle Godefroy, Lynne Guo, Lene Kollmorgen, Toluwalope Cole, Catherine Chene, Praveena Deenumsetti, Anne Doisy, Ariane Vialfont, Melissa Charbit, Christine Shu, Stephane Kirkesseli, Howard Surks, Magalie De Meyer, Edel Hendrickx e Paul Deutsch (julgamento da Sanofi); Ellie Carmody, Märtin Backer, Jaishvi Eapen, Jack A. DeHovitz, Prithiv J. Prasad, Yi Li, Camila Delgado, Morris Jrada, Gabriel A. Robbins, Brooklyn Henderson, Alexander Hrycko, Dinuli Delpachitra, Vanessa Raabe, Jonathan S. austríaco, e Yanina Dubrovskaya (ensaio TEACH); Farah Al-Beidh, Djillali Annane, Kenneth Baillie, Abigail Beane, Richard Beasley, Zahra Bhimani, Marc Bonten, Charlotte Bradbury, Frank Brunkhorst, Meredith Buxton, Allen Cheng, Menno de Jong, Eamon Duffy, Lise Estcourt, Rob Fowler, Timothy Girard , Herman Goossens, Cameron Green, Rashan Haniffa, Christopher Horvat, David Huang, Francois Lamontagne, Patrick Lawler, Kelsey Linstrum, Edward Litton, John Marshall, Daniel McAuley, Shay McGuinness, Stephanie Montgomery, Paul Mouncey, Katrina Orr, Rachael Parke, Jane Parker, Asad Patanwala, Kathryn Rowan, Marlene Santos, Christopher Seymour, Steven , Anne Turner, Timothy Uyeki, Wilma van Bentum-Puijk, Frank van de Veerdonk e Ryan Zarychanski (ensaio REMAP-CAP); Jan-Erik Berdal, Arne Eskesen, Dag Kvale, Inge Christoffer Olsen, Corina Silvia Rueegg, Anbjørg Rangberg, Christine Monceyron Jonassen e Torbjørn Omland (NO COVID-19 julgamento). O suporte para a criação e o formato da página de título foi fornecido pelo AuthorArranger, uma ferramenta desenvolvida no National Cancer Institute. Rachael Parke, Jane Parker, Asad Patanwala, Kathryn Rowan, Marlene Santos, Christopher Seymour, Steven Tong, Anne Turner, Timothy Uyeki, Wilma van Bentum-Puijk, Frank van de Veerdonk e Ryan Zarychanski (julgamento REMAP-CAP); Jan-Erik Berdal, Arne Eskesen, Dag Kvale, Inge Christoffer Olsen, Corina Silvia Rueegg, Anbjørg Rangberg, Christine Monceyron Jonassen e Torbjørn Omland (NO COVID-19 julgamento). O suporte para a criação e o formato da página de título foi fornecido pelo AuthorArranger, uma ferramenta desenvolvida no National Cancer Institute. Rachael Parke, Jane Parker, Asad Patanwala, Kathryn Rowan, Marlene Santos, Christopher Seymour, Steven Tong, Anne Turner, Timothy Uyeki, Wilma van Bentum-Puijk, Frank van de Veerdonk e Ryan Zarychanski (julgamento REMAP-CAP); Jan-Erik Berdal, Arne Eskesen, Dag Kvale, Inge Christoffer Olsen, Corina Silvia Rueegg, Anbjørg Rangberg, Christine Monceyron Jonassen e Torbjørn Omland (NO COVID-19 julgamento). O suporte para a criação e o formato da página de título foi fornecido pelo AuthorArranger, uma ferramenta desenvolvida no National Cancer Institute. Christine Monceyron Jonassen e Torbjørn Omland (SEM julgamento COVID-19). O suporte para a criação e o formato da página de título foi fornecido pelo AuthorArranger, uma ferramenta desenvolvida no National Cancer Institute. Christine Monceyron Jonassen e Torbjørn Omland (SEM julgamento COVID-19). O suporte para a criação e o formato da página de título foi fornecido pelo AuthorArranger, uma ferramenta desenvolvida no National Cancer Institute.
Esta meta-análise colaborativa foi apoiada pela Swiss National Science Foundation e Laura and John Arnold Foundation (concessão de apoio à bolsa de pós-doutorado no Meta-Research Innovation Center em Stanford (METRICS), Stanford University). O financiamento também inclui bolsas de pós-doutorado da Uppsala University, da Swedish Society of Medicine, da Blanceflor Foundation e da Sweden-America Foundation (CA). Os financiadores não tiveram nenhum papel na concepção desta meta-análise colaborativa; na coleta, análise e interpretação dos dados; ou na redação do relatório. O autor para correspondência teve acesso total a todos os dados do estudo e responsabilidade final pela decisão de envio para publicação.
Informação sobre o autor
Afiliações
Contribuições
LGH, CA e AMS tiveram acesso total a todos os dados deste estudo e assumem a responsabilidade pela integridade dos dados e pela precisão da análise dos dados. Conceito e design: LGH, JPAI, CA, AMS, SNG e DM Aquisição, análise ou interpretação dos dados: todos os autores. Redação do manuscrito: CA, AMS e LGH Revisão crítica do manuscrito quanto ao conteúdo intelectual importante: todos os autores. Análise estatística: AMS, LGH, JPAI, SNG e PJ. Aprovação do manuscrito final: todos os autores. Financiamento obtido: LGH, CA e JPAI Suporte administrativo, técnico ou material: CA, AMS, LGH, PJ e JvH Supervisão: LGH
autor correspondente
Declarações de ética
Interesses competitivos
BSA e RKA são os investigadores principais do estudo de Prevenção e Tratamento de COVID19 com Hidroxicloroquina (PATCH), financiado por uma doação filantrópica. RKA relata ser fundador com patrimônio da Pinpoint Therapeutics and Immunacell, e honorários pessoais da Sprint Biosciences e Deciphera, fora do trabalho submetido. DCA relata taxas pessoais da Ferring Pharmaceuticals, Inc., Bristol-Myers Squibb e Bayer AG, outra da Alung Technologies, Inc., fora do trabalho submetido; além disso, o DCA tem patentes pendentes para Selepressina - compostos, composições e métodos para o tratamento da sepse para Ferring, BV, e biomarcadores proteômicos de sepse em pacientes idosos, pendentes para a Universidade de Pittsburgh. YMA relata que ele é o principal investigador em um ensaio clínico de lopinavir-ritonavir e interferon para a síndrome respiratória do Oriente Médio (MERS) e que foi consultor não remunerado em terapêutica para MERS-coronavírus (CoV) para Gilead Sciences e SAB Biotherapeutics. Ele é co-investigador do Teste Randomizado, Incorporado e Multi-fatorial de Plataforma Adaptável para Pneumonia Adquirida pela Comunidade (REMAP-CAP), membro do conselho do Consórcio Internacional de Infecções Respiratórias Agudas Graves e Emergentes (ISARIC), e o Coordenador de Chumbo da Força-Tarefa Think20 (T20) para COVID-19. Brigham and Women's Hospital, PRA Health Science e Cliniques universitaires Saint-Luc receberam fundos da Sanofi. TB relata subsídios da Pfizer, Fundação Novo Nordisk, Fundação Simonsen, Fundação Lundbeck e Fundação Kai Hansen; subsídios e taxas pessoais da GSK, Pfizer, Boehringer Ingelheim e Gilead; e taxas pessoais da MSD, todas fora do trabalho enviado. YZC, LNC, BI e LP são funcionários da Sanofi. Os ensaios COV-HCQ e COMIHY foram apoiados pelo Ministério Federal da Educação e Pesquisa da Alemanha (número EudraCT 2020-001224-33) e pelo Ministério Federal da Saúde da Alemanha (número EudraCT 2020-001512-26). LD relata subsídios da UE FP7-HEALTH-2013-INNOVATION-1, subsídio número 602525, subsídios de H2020 RECOVER, convenção de subsídio no. 101003589, durante a realização do estudo; e é membro do comitê de diretrizes COVID-19 SCCM / ESICM / SSC, membro da força-tarefa ESICM COVID-19 e presidente da força-tarefa de ameaças infecciosas de intensivistas holandeses (NVIC). VD relata apoio não financeiro da MSD França e da Sanofi Aventis França, fora do trabalho submetido. AE é funcionário da Ividata Life Sciences e trabalha como contratado externo para a Sanofi. ACG recebeu financiamento do NIHR Research Professorship (RP-2015-06-18), apoio do NIHR Imperial Biomedical Research Center e taxas de consultoria pagas à sua instituição pela GlaxoSmithKline e Bristol-Myers Squibb. TH relata bolsas do Conselho de Pesquisa em Saúde da Nova Zelândia, durante a realização do estudo. A AIMH relata doações da ZonMw, organização holandesa para Pesquisa e Desenvolvimento em Saúde, durante a realização do estudo. O ensaio HYDRA foi um estudo iniciado pelo investigador apoiado pela Sanofi, CONACYT (Conselho Nacional de Ciência e Tecnologia do México) e pelos centros participantes. Thuy Le relata bolsas da Gilead Sciences, fora do trabalho submetido. BJM relata concessões do NIH / NHLBI e da Bayer Pharmaceuticals, Inc., fora do trabalho submetido. SM recebe financiamento como Presidente da Innovative Medicines Canada em Preparação para Pandemia. CM relata bolsas do Conselho de Pesquisa em Saúde da Nova Zelândia. MJM relata ter recebido o medicamento HCQ do governo do Estado de Nova York, durante a realização do estudo; bolsas da Lilly, Pfizer, Sanofi e honorários pessoais da Meissa, fora do trabalho inscrito; além disso, a MJM tem uma patente pendente monoclonal ab / Emory Univ. AN é apoiado por um Prêmio da Rede de Ensaios Clínicos do Conselho de Pesquisa em Saúde da Irlanda (HRB-CTH-2014-012). LP é funcionário da Excelya e trabalha como contratado externo para a Sanofi. FWR relata taxas pessoais de Merck Research Labs, Novartis, Lilly, Sanofi, NovoNordisk, KLSMC, Tolerion, Rhythm, UCB, AstraZeneca, Janssen, Merck KGaA, Sarepta, Eidos, Amgen, Phathom, fora do trabalho submetido; e ter participação acionária na GlaxoSmithkline, Athira Pharma, DataVant, Spencer Healthcare. SRW relata ter recebido uma bolsa da Sanofi durante a realização do estudo e bolsas do NIH-NIAID fora do trabalho submetido, e ter conduzido testes clínicos de vacinas (HIV, Zika) financiados pela Janssen. O SAW relata doações do National Health and Medical Research Council (Austrália), do Minderoo Foundation, do Health Research Council (Nova Zelândia) e do Medical Research Future Fund (Austrália), durante a realização do estudo. JMW relata doações da ZonMw, organização holandesa para Pesquisa e Desenvolvimento em Saúde, durante a realização do estudo. FGZ fazia parte do estudo da Coalizão 1 parcialmente apoiado pela EMS Pharmaceuticals, recebeu doações anteriores da Bactiguard, Suécia, fora do trabalho submetido, e apoio da Baxter LA para outro ensaio clínico em pacientes criticamente enfermos. Nenhum dos outros autores tem interesses conflitantes a declarar.
Informação adicional
Informações da revisão por pares A Nature Communications agradece ao (s) revisor (es) anônimo (s) por sua contribuição para a revisão por pares deste trabalho. Relatórios de revisores pares estão disponíveis.
Nota do editor A Springer Nature permanece neutra em relação a reivindicações jurisdicionais em mapas publicados e afiliações institucionais.
Informação suplementar
Dados de origem
Direitos e permissões
Acesso aberto Este artigo está licenciado sob uma Licença Internacional Creative Commons Atribuição 4.0, que permite o uso, compartilhamento, adaptação, distribuição e reprodução em qualquer meio ou formato, desde que você dê os devidos créditos ao (s) autor (es) original (is) e à fonte, fornecer um link para a licença Creative Commons e indicar se foram feitas alterações. As imagens ou outro material de terceiros neste artigo estão incluídos na licença Creative Commons do artigo, a menos que indicado de outra forma em uma linha de crédito para o material. Se o material não estiver incluído na licença Creative Commons do artigo e seu uso pretendido não for permitido por regulamentação legal ou exceder o uso permitido, você precisará obter permissão diretamente do detentor dos direitos autorais. Para ver uma cópia desta licença, visitehttp://creativecommons.org/licenses/by/4.0/ .
Nenhum comentário:
Postar um comentário